まずは自己紹介から.今回は7名の精鋭が分子実験に挑みます.
オリエンテーションの後から実習がスタートです.まずは朝倉先生による分類学についての講義が始まりました.
初日ではありますが,この日は夜の部もありました.夜はマイクロピペットの操作方法やチューブの扱い方を練習します.
この実習では白衣がユニフォームです.気分的にも盛り上がります…よね?
初心者も経験者もいましたが,みんなでチューブの蓋の締め方からマイクロピペットによる分注までを練習しました.
2日目はいよいよDNA抽出作業からスタートです.まずはエタノールで固定された標本から組織を切り出してもらいましょう.こちらのテーブルではウニから始める模様です.
今回の実習では,特定助教の加賀谷先生も分子実験に飛び入り参加です.ウニを解剖して殻の内側に位置している瓶嚢(びんのう)を抽出に使います.
ウニを解剖した人ならわかるはず.そう,瓶嚢とは管足の基部にある袋状の器官ですよね.
切り出した組織をチューブに入れていきます.初めてやる場合にはなかなか緊張する作業です.
各種のbufferを注ぎ,高速遠心機にかけていきます.写真が代わり映えしないので割愛!
DNA抽出がおわったら,いよいよPCRで目的の領域を増幅していきます.
やはり代わり映えしないので,実習室全体の雰囲気をお伝えしましょう.こんな感じで白衣の集団は実験を進めていきます.
PCRが終わるまでの待ち時間に,電気泳動用のゲルを作成しておきます.適量を混ぜてレンジでチンするだけの作業ですが,みんな真剣です.
出来上がったゲルをトレイに流し込み,固まるまで30分待ちます.気泡が入らないように注意しましょう.やってる内容は,ほぼ料理と一緒です.適量を適切にまぜるだけ.
ゲルが固まったら,PCRの結果を確認するために電気泳動を行います.みなさん左手人差し指の使い方が様になっていますね.
DNAの増幅を確認したら,PCR産物を精製して塩基配列の決定を業者に発注します.何の事やらわからないという方は,是非実習に参加してみてください(うっすらと宣伝).
この日の残り時間は,解析用ソフトのインストールやデータベースから塩基配列をダウンロードする方法を体験して終了です.
外注したシーケンスデータが帰ってくるまでは2日ほど時間がかかります.その間に,実習で扱っている生き物の生息環境を実際に観察してもらい,来年の実習で使用するサンプルの採集をしてもらいました.
まずは実験所近くの番所崎でウニの採集をしました.ナガウニは全タイプゲットできたでしょうか?
干潟近くの水門では,ケフサイソガニやイボニシの採集をしました.
写真のように石をひっくり返すと,その下にはカニさんが隠れています.まだ寒いので,活動が活発ではありません.採集のチャンスです.
ラボに戻ったら,早速観察の開始です.写真のように海水を冷やすことで,プランクトンの動きを鈍くし観察しやすくしています.
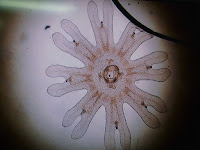
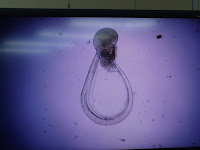
今回の実習ではオキクラゲのエフィラと定番のオタマボヤが見つかりました.もちろん他にもたくさんのプランクトンが観察できますよ.
翌日には採集してきた生物の同定と標本作成を行いました.ここでも「白浜の海岸生物観察ガイド」は大活躍です(宣伝).
かなり大量のウニですが,7人もいればあっという間に同定できるでしょう.
貝の標本は,このように一度茹でて身を取り出し(肉抜き),肉片の一部はDNA解析用にエタノール固定,残りは形態観察用にホルマリン固定,殻は乾燥させてやはり形態観察に使用します.
肉抜きは貝の種類によって最適な茹で時間などがある奥の深い世界です.今回の実習生はとても器用に標本を作成できたようです.
この日の午後は,外注していたシーケンスが届いたので,ソフトの使い方を学びつつ系統解析に挑戦です.
実習6日目は,5つの講義がつづく座学デーです.朝から昼過ぎまで,内容の濃い講義のオンパレードです.
連続の講義を生き残った実習生達は,あすの研究発表の準備に余念がありません.
解析の方法や系統樹の解釈など,みんなで少しずつアイデアを出しながら進めているようです.もちろん研究の考察は,自分の力でまとめます.
もういっその事,7人全員で取り組みましょう.文殊の知恵より2倍以上効率アップ…かも.
この日は実習中最後の夜なので,まだ明日の研究発表は残っていますが打ち上げパーティーです.参加者にとっては、明日に備えて気持ち控えめの打ち上げだったかもしれませんね。
実習も最終日を迎えて、いよいよ研究発表が始まります。今回は7人で4つのテーマについて発表してもらいます。
こちらは採集された「謎」のプランクトンを分子同定してくれました。
そしてこちらのチームは,ケフサイソガニとタカノケフサイソガニの違いを分子データで検証してくれました。
発表を終えた解放感がにじみ出た一枚です.8日間お疲れ様でした.